氧化是日常生活中常見到的化學反應,有的是激烈迅速的,像物質的燃燒;有些則是較緩慢的,像鐵生鏽...... 教學上常會將『燃燒與生鏽』這二個與O2化合的反應一起比較。
以鐵為例,為了提高燃燒反應速率,用接觸面積大鋼絲絨,燃燒後變成氧化鐵Fe2O3,鐵被氧化。不過~常常會有概念迷失,『如果鐵鏽成份是氧化鐵,與燃燒一樣,那麼為何生鏽在純氧中不會反應,一定要有"水"?且"酸與鹽"還能加速反應呢?』
台中有許多溝圳流過市區,所以周圍多半會加上欄杆,某天經過一處發現鐵欄杆鏽蝕好嚴重。鐵生鏽後的成份是什麼?同樣是氧化,與鐵燃燒有什麼不一樣?

河邊鐵欄杆常常會生鏽,彎處或焊接處可能因受力結構破壞,而更易生鏽。

鐵鏽沒有緻密的組織,脫落後使內部的鐵暴露,水和氧氣會穿透鐵鏽,繼續使內部的鐵被鏽蝕。
其實,鐵鏽是一些鐵氧化物的統稱,通常為紅色,由鐵和氧氣在潮濕環境下生成,不同情況下會生成不同形式鐵的水合物 Fe2O3·nH2O 和 Fe(OH)3.xH2O
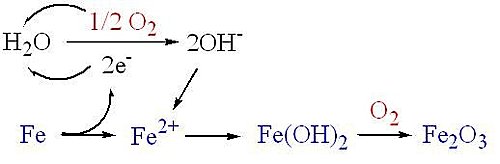
『鐵生鏽』是氧化還原反應,當鐵原子失去電子變成Fe2+離子時,鐵金屬就開始生鏽。
1.反應的第一步是鐵氧化為亞鐵離子,會因為電解質(酸、鹽)而加速: 2Fe → 2F e2+ + 4 e− (式1)
2.潮溼空氣下,氧的還原產生氫氧根離子 O2 + 2 H2O + 4 e- → 4 OH- (式2)
3. Fe2+與OH-生成氫氧化亞鐵(黑鏽) Fe2+ + 2 OH- → Fe(OH)2 (式3)
4. 綜合(式1、2、3) 全反應: 2Fe + O2 + 2H2O → 2F e(OH)2 (式4)
若有氧的存在,亞鐵離子還會再度氧化成紅鏽 (氧化鐵) 4Fe(OH)2 + O2 →2Fe2O3 + 4H2O (式5)
在高中實驗,利用赤血鹽K3F e(CN)6及幾滴酚酞,檢驗生鏽過程中的Fe2+及 OH-。Fe2+ 與赤血鹽K3F e(CN)6 反應生成的藍色沉澱,酚酞與OH-呈現桃紅色。
紅鏽為水合氧化鐵 Fe2O3‧xH2O,寫成 4Fe(OH)2 + O2 + (2x-4)H2O →2 [Fe2O3‧xH2O] (式6) b 若以x=3為例,反應式寫做 4Fe(OH)2 + O2 + 2H2O →2 [Fe2O3‧3H2O]
由鐵出發的反應方程式 4Fe + 3O2 + 3H2O → 2 Fe2O3‧3H2O

表面看似無鏽,內部會”穿孔腐蝕”。

鐵鏽黑黑紅紅~是複雜的鐵氧化物。

生鏽與水有關,看似水痕流動~一但鏽斑留下痕跡,是很難再用水洗去的。
事實上~鐵鏽還更複雜些...
『鏽』是金屬表面因氧化而產生的氧化物或是氫氧化物,溶氧量有限,較容易產生含Fe2+離子的產物,例如:氧化亞鐵Fe(OH)2及黑色的四氧化三鐵Fe3O4;若溶氧量高,則會產生Fe3+的產物。鐵鏽中的固體仍在緩慢的進行化學反應,使得鐵鏽的成份會隨時間變化:
氫氧化亞鐵 Fe(OH)2 ⇌ FeO + H2O
氫氧化鐵 Fe(OH)3 ⇌ FeO(OH) + H2O ; 2 FeO(OH) ⇌ Fe2O3 + H2O
綜而言之~鐵生鏽鐵燃燒可在純氧中進行,形成氧化鐵;鐵的生鏽則要在有水有氧的情況下進行,生鏽後卻未必只是氧化鐵,記住~鐵生鏽複雜多了!如果是靠海附近,水氣加鹽分,更是容易生鏽。
分類:科學五四三 2010/03/09 06:59

