因應新流感疫情,衛生組定期請各班以稀釋過後的漂白水進行消毒。『消毒之前,是否可以順便來些實驗呢?』喜歡這種信手拈來的實驗,就當做有碘不一樣的最終回吧!
課堂上,考考二年級的學生,這可是月考範圍:『漂白水是氧化劑,還是還原劑?』氧化劑,還好大家都會,其中的次氯酸根為氧化劑。
『碘與還原劑(維他命C)反應,會被還原而使顏色消失,』順便複習曾做過的實驗:『那麼,碘遇上了氧化劑,會不會反應?顏色會不會也消失呢?』很多學生都認為不會。 之前做過碘會與維他命C反應而消失的實驗:碘被還原成碘離子,可以玩紅茶消失術或是紅茶變汽水(有『碘』不一樣(5)~寶特瓶紅茶消失術)。
『那麼就來做實驗囉!』
請學生去找資源回收筒找透明塑膠杯(我的學生常常翻回收筒…), 在塑膠杯中加了碘酒,先變成淡茶色,加再多又變成『紅茶』。這是因為溶液的顏色隨碘酒的濃度而變。(相片特寫是課後請學生協助補拍的。)
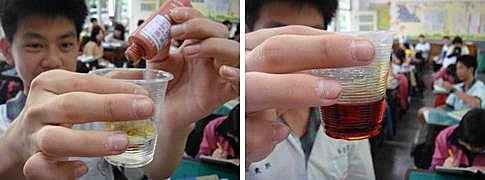
漂白水一下去……不用搖,很快變色,又回復到澄清。
在維他命C的反應中要搖晃是因為要將之溶解,反應才快;而漂白水本身已經溶解成溶液,反應很快。這也是為什麼許多化學反應在保存時為固體,而要進行化學反應中則要配成溶液,除了便於定量,也因為溶質粒子小,碰撞機會大~反應快。『碘與氧化劑(漂白水)反應,會被氧化而使顏色消失。』 怎麼會被還原,也會被氧化?
碘遇上氧化劑、還原劑都會使顏色消失,不過是變成不一樣的東西!維他命C具還原作用,是一種還原劑,碘碰上維他命C,被還原後,碘即成為碘離子(無色)。而碘碰上漂白水,被氧化後,碘即成為碘酸根,也是無色。 (附註,關於漂白水的作用,我寫因為氧化,但是~『我今天拿漂白水來試驗了一下,的確會變成無色。 但是我對這個顏色變化的解釋比較傾向用漂白水的鹼性來解釋..』小P老師回應指正:『漂白水的鹼性還蠻強的,應該很容易造成自身氧化還原,讓顏色消失。 我另外有用高濃度的雙氧水和碘液反應,結果是不會變色的。 但如果把維他命C放入碘液中,讓顏色消失,再加雙氧水進去,顏色是會變回來的..』以漂白水的鹼性來解釋~ 妙呀!!我倒忽略這一點,碘在鹼性條件下是會自身氧化還原的。 經小P老師的提醒,讓我也解決另一個實驗之謎,不一定是氧化劑或還原劑,有時添加物質的酸鹼性,才是造成反應的主因。
『碘會被氧化也會被還原,在鹼性條件下,碘會進行自身氧化還原反應。』當然又要實驗操作給學生看了。(自身氧化還原反應:氧化劑還原劑均為同一物質,雙氧水分解出氧氣與水的反應也是)
碘液加鹼變色了!

碘液為紅棕色,碘離子及碘酸根離子為無色,可以見到碘液由紅棕色變為無色。
在黑板上寫下反應式:
3I2 (紅褐色)+ 6OH- ⇄ 5I- (無色)+ IO3- (無色)+ 3 H2O
碘遇上了氫氧化鈉溶液會產生自身氧化還原現象,氧化,得到氧或失去電子,氧化數增加;還原,失去氧或得到電子,氧化數減少。I2的氧化數為0,I-的氧化數為-1,IO3-中I的氧化數為+5,碘得到電子還原成無色的碘離子;同時部份的碘失去電子氧化成碘酸根。
『猜猜~加酸會如何?』平衡往( 左 ),顏色( 又回復原來的紅褐色 )。
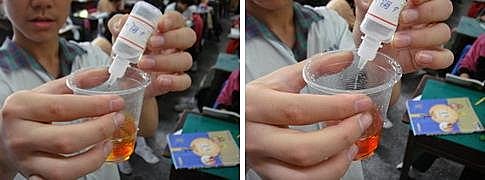
碘在( 酸 )性條件下較穩定。
『再加鹼!』顏色又消失!重複操作上述步驟,分別加鹼與酸,則紅褐色的碘溶液一下子褪為無色,一下子顏色又出現,這個反應式也可以順便作化學平衡移動的示範。
然後~這杯溶液就要倒掉了嗎?
沒這麼簡單,先加入碳酸氫鈉,再倒入酸……『沙士、啤酒,變出來了!』顏色之外,來點小小的氣泡,更迷人!

倘若要讓變色更豐富,在酸性環境下加入酚酞,此時溶液為碘液的紅褐色;再加入鹼,碘的顏色消失,酚酞將鹼性的溶液變成紫紅色!或著加入澱粉液,使碘與澱粉結合成的藍紫(藍黑)色,也是一個變化。(我的澱粉液通常會利用營養午餐的白飯,用個小袋子裝少許,在課堂上當著學生面前加水、揉擠……他們會很high~)
而印象中, 蕭次融 老師的『神奇的七個杯子』,還有一個絕招,是利用火柴:點燃一支火柴,立即放進杯子,用另一個杯子當做蓋子,保住燃燒火柴產生的二氧化硫。此時還沒變色,再搖一搖杯子,讓二氧化硫溶於水形成亞硫酸,則溶液又會褪為無色。這個技巧我還學不會~燒破好幾個杯子……
碘與雙氧水,都能進行自身氧化還原反應,碘或碘離子,如果遇上雙氧水又會如何?誰被氧化?誰被還原?雙氧水的氧化性,能把碘離子氧化成碘,如果I2又與澱粉結合……..這可是高中化學一個有趣的實驗與計算哩!
課堂上或家中,有『碘』真的不一樣,只要一罐碘酒......透過演示操作的顏色變化,學習科學~有如變魔術,讓生活加些小趣味。
有『碘』不一樣(1)~泡沫傳情實驗
有『碘』不一樣(2)~偽鈔辨識筆
有『碘』不一樣(3)~自製『可擦拭墨水筆』
有『碘』不一樣(4)~『紅茶變汽水』
有『碘』不一樣(5)~寶特瓶紅茶消失術
有『碘』不一樣(6)最終回~碘的自身氧化還原
分類:科學動手做 2009/06/02 06:45

